父母是非常慈爱的,
而我太年少未能体会。
高原的崇山与深谷美丽无比,
未曾见过低地的我,何其愚昧。
生物分子相互作用是一种基本的生命现象,其相互作用研究是现代生命科学研究的重大问题之一。现在研究相互作用的技术有:平衡透析法、紫外可见吸收光谱、荧光光谱、电化学法等。随着分子生药研究深入,一些新的检测技术问世,如微量热泳动技术(MST),那么当我们做蛋白相互作用时,面对如此多的技术,该如何让选择?笔者将目前测定小分子与蛋白的体外相互作用,最常用的四种技术:荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA)、等温量热滴定仪(ITC)、表面离子体共振技术(SPR)等技术的原理、操作、应用范围以及优缺点做一综述,供各位研究者参考。其中FPIA和ITC是两种经典方法。
- 寨卡病毒病由通过伊蚊传播的一种病毒引起。
- 寨卡病毒病患者的症状可能包括轻微发热、皮疹、结膜炎、肌肉和关节疼痛、浑身虚弱或头痛。
- 这些症状通常持续2-7天。科学界的共识是寨卡病毒是小头症和吉兰–巴雷综合征的一个病因。
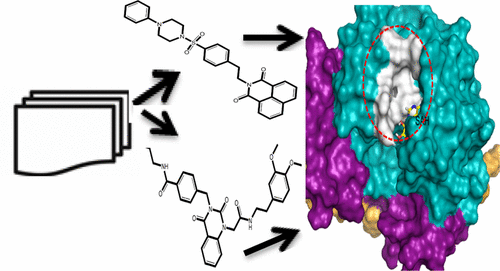
安全药物的选择性在靶点验证过程中是非常重要的。选择性对于药物设计增添了不少的复杂性,因为它设计到多重结合亲和力的优化过程。从计算角度来讲,结合选择性预测是具有挑战性的,通用的方法仍无法使用。基于化学途径的绝对结合自由能计算为亲和力预测提供了框架。本文作者利用三个溴结构域抑制剂,评价了基于分子动力学模拟计算得到的自由能,并和等温滴定量热法数据进行了比较。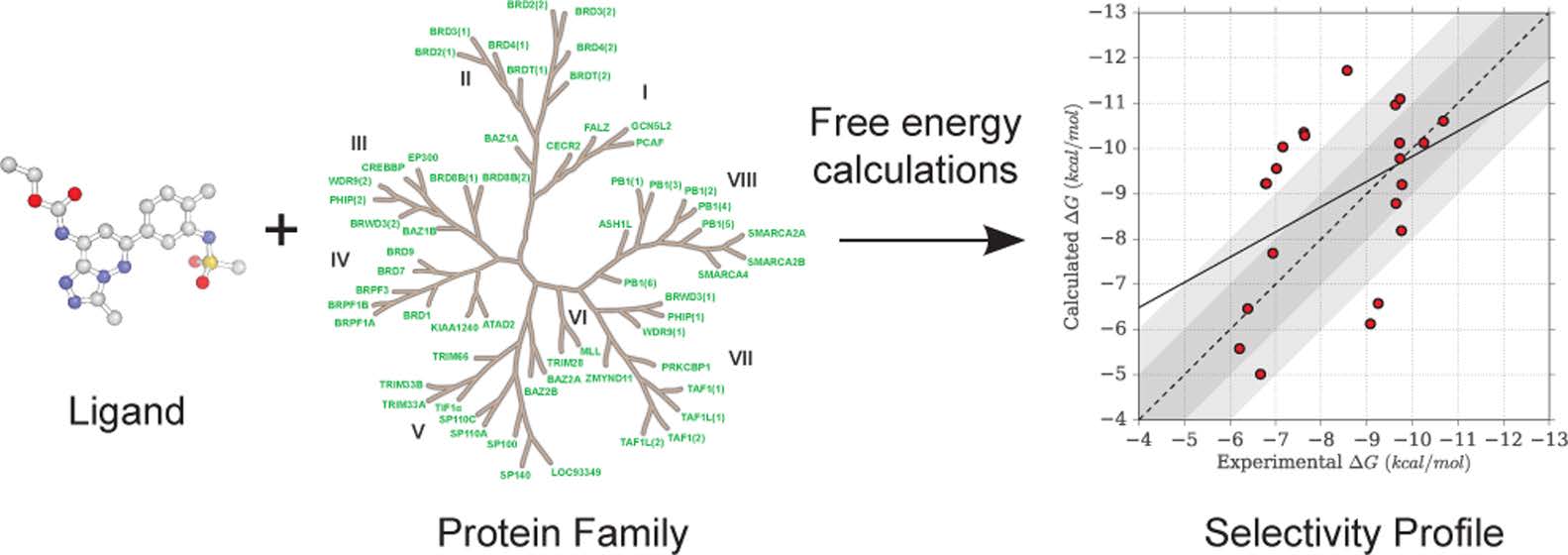
※※※※※※※ 影片信息 ※※※※※※※
◎译 名 斯巴达克斯:血与沙
◎片 名 Spartacus: Blood and Sand
◎年 代 2010
◎国 家 美国
◎类 别 传记/古装/动作/冒险
◎语 言 英语
◎字 幕 中文
◎IMDB评分 8.7/10.0(125,442 votes)
◎IMDB链接 http://www.imdb.com/title/tt1442449
容器类:
量杯 measuring cup
烧杯 beaker 不锈钢杯stainless-steel beaker
量筒 measuring flask/measuring cylinder 量筒 graduated flask/measuring cylinder
坩埚 crucible 坩埚钳 crucible clamp 坩埚 crucible pot, melting pot